




Am 26.05.2021 war es soweit - es wurde die bisher bekannte Medizinprodukterichtlinie 93/42/EWG von der neuen Medizinprodukteverordnung (EU) 2017/745 (MDR, Medical Device Regulation) abgelöst, die europaweit gültig ist.
Die neue MDR bedeutet für uns als Hersteller aber auch für Sie als Fachhändler, dass einige Veränderungen auf uns zukommen was die Produktion und den Handel von Medizinprodukten angeht. Wir beantworten Ihnen die wichtigsten Fragen zur neuen MDR 2021.
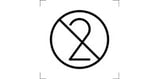
Die Kennzeichnung von Medizinprodukten der Klasse I (nicht steril) muss folgende, von Menschen lesbare, Angaben enthalten (Auszug):
Die Kennzeichnung von Medizinprodukten der Klasse Is (steril) muss folgende, von Menschen lesbare, Angaben enthalten (Auszug):

|

|

|

|

|

|

|

|
|

|

|

|

|

|

|

|

|

|

|

Sterilisation durch Dampf oder trockene Wärme |
Produkte, welche noch nach der alten MDD produziert wurden, dürfen bei sachgerechter Lagerung und intakter Verpackung weiterhin verwendet werden - natürlich innerhalb des angegebenen Haltbarkeitsdatums.
Nach Artikel 120 MDR lautet die Abverkaufsregelung folgendermaßen: Produkte, die vor dem 26.05.2021 nach altem Recht (MDD) rechtmäßig in Verkehr gebracht, sowie Produkte, die ab dem 26.05.2021 mit einem weiterhin gültigen MDD-Zertifikat in Verkehr gebracht werden, können bis zum 27.05.2025 weiter auf dem Markt bereitgestellt oder in Betrieb genommen werden.
Nein, das ist in der neuen MDR nicht vorgesehen.
Nein, derzeit sieht die MDR keine Registrierungspflicht der Händler vor.
Grundsätzlich dürfen Medizinprodukte nicht verändert werden. Sollten Medizinprodukte in Sets weiterverarbeitet werden, so hat der Händler dies entsprechend zu dokumentieren und ein Qualitätsmanagementsystem aufrechtzuerhalten. Eine gegebenenfalls notwendige Registrierung des Händlers hierfür muss geprüft werden.
Dies dient rein informativen Zwecken, ersetzt keine rechtliche Beratung und bietet keine rechtliche Sicherheit. Alle Angaben sind ohne Gewähr. Änderungen und Irrtümer sind vorbehalten.
Wir stellen Ihnen gerne sowohl die aktuelle Version der Medizinprodukteverordnung (EU) 2017/745 sowie unser kompaktes Whitepaper zum Thema mit allen nötigen Infos übersichtlich zusammengefasst zur Verfügung.
Kostenloses Whitepaper mit einem kompakten Überblick der MDR 2021
Link zur Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates
Die Details und neuen Bestimmungen der MDR 2021 können manchmal recht verwirrend sein. Gerne stehen wir Ihnen bei allen Fragen rund um die neue MDR 2021 helfend zur Seite.
Zum Thema Alle
ACTIOMEDIC® ist eine Marke von
GRAMM medical steht seit über 100 Jahren für die Entwicklung und Herstellung von Medizinprodukten. Als deutscher Medizinproduktehersteller setzen wir den Fokus auf erstklassige Qualität und innovative Produktlösungen für den professionellen, betrieblichen und privaten Einsatz.